Algunas propiedades como el punto de fusión y ebullición de los compuestos covalentes, pueden ser explicados con base a las fuerzas intermoleculares que mantienen unidas a las moléculas, estas fuerzas son débiles, por lo que, en general, se requiere suministrar menor energía para que las sustancias cambien de estado de agregación. Es decir, las fuerzas que unen a los átomos (enlaces atómicos) como los covalentes, son mayores que las fuerzas que unen moléculas (enlaces intermoleculares).
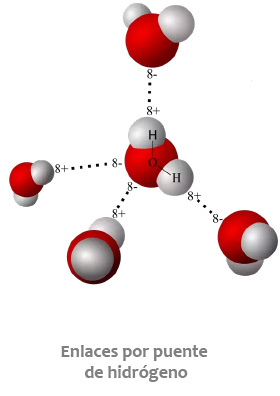
Las moléculas de los compuestos covalentes se pueden mantener unidas entre sí a través de interacciones de carácter electrostático que se conocen de forma genérica como "fuerzas intermoleculares ". Estas fuerzas se clasifican en dos tipos básicos: enlaces por puente de hidrógeno y fuerzas de Van der Waals.
Para conocer cómo se generan estas fuerzas de atracción da clic en cada imagen: