Los compuestos químicos se forman por la combinación química de dos o más elementos diferentes unidos entre sí en proporción fija, se pueden separar mediante métodos químicos en sustancias (elementos o compuestos) con una estructura química más sencilla. Tienen propiedades diferentes a las de los elementos que los componen. A continuación se presentan dos ejemplos, el del Cloruro de sodio y el del Óxido de aluminio:

Cloruro de sodio (NaCl)
La relación de los átomos de sodio con respecto a los átomos de cloro es 1 a 1. El Cloruro de sodio es posible separarlo en sus elementos componentes (sodio y cloro), por medio de un método químico llamado electrólisis.

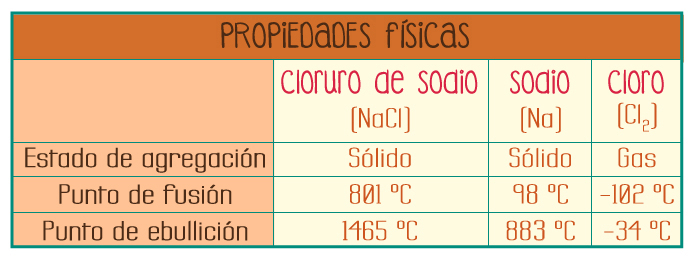
Información tomada de: CRC Handbook of Chemistry and Physics. Edición 88th, 2007-2008. Páginas: 4-89, 4-58.
Como nos podemos dar cuenta, las propiedades físicas de los elementos componentes (sodio y cloro) son completamente diferentes a las del compuesto (cloruro de sodio).

Óxido de aluminio (Al2O3)
La relación de los átomos de aluminio con respecto a los átomos de oxígeno es: 2 a 3. El óxido de aluminio es posible separarlo en sus elementos componentes (aluminio y oxígeno) por medio de un método químico llamado electrólisis.

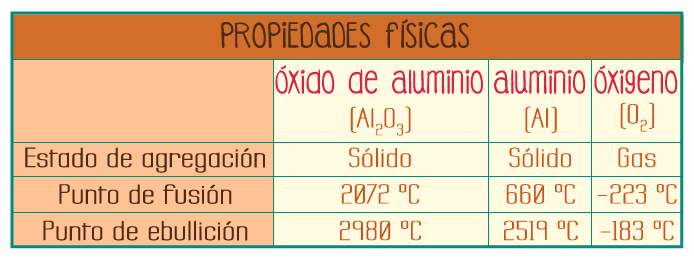
Información tomada de: CRC Handbook of Chemistry and Physics. Edición 88th, 2007-2008. Páginas: 4-44, 4-45, 4-79.
Como puedes darte cuenta, las propiedades físicas de los elementos componentes (aluminio y oxígeno) son completamente diferentes a las del compuesto (óxido de aluminio).
- Química 1
- Ejercicio 3
- Unidad 1
- Mezclas
- Reacciones Químicas
- Introducción
- Elementos
- Compuestos
- Ley de las proporciones definidas
- Fórmulas de los compuestos
- Cambio físico y químico
- Reacción química
- Ley de la conservación de la materia y Ley de la conservación de la energía
- Ecuación química
- Reacción exotérmica y endotérmica
- Lenguaje químico
- Actividad final
- Bibliografía
- Créditos
- Agua: compuesto o elemento
- Unidad 2


