Una ecuación química es un enunciado que utiliza fórmulas químicas para describir las identidades y cantidades relativas de los reactivos y productos involucrados en una reacción química.
Para poder representar lo que ocurre en una reacción química mediante una ecuación, ésta debe cumplir con la Ley de la conservación de la materia y con la Ley de conservación de la energía. Es decir, la ecuación debe indicar que el número de átomos de los reactivos y productos es igual en ambos lados de la flecha y que las cargas también lo son. Dicho en otras palabras, se debe contar con una ecuación balanceada.
Por ejemplo en la siguiente ecuación química, analicemos cuáles son las sustancias participantes a lo largo de la ecuación:

Participa 1 átomo de carbono, 1 átomo de oxígeno y 6 átomos de hidrógeno.
Si realizamos la suma de los átomos totales que participan del lado de reactivos observamos que es igual a 8 átomos:
Participa 1 átomo de carbono, 1 átomo de oxígeno y 6 átomos de hidrógeno.
Si realizamos la suma de los átomos totales que participan del lado de productos observamos que es igual a 8 átomos.
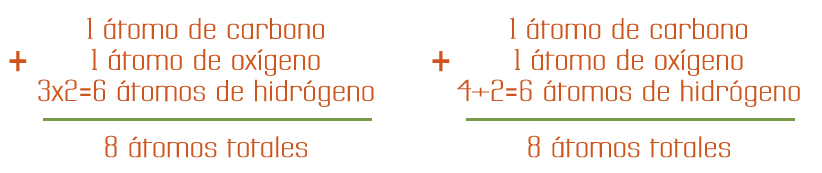
Como podemos observar, en una ecuación química, es obligatorio escribir correctamente las fórmulas y símbolos de las sustancias participantes, así como las cantidades de sus moléculas, con el fin de poder representar de manera fiel lo que ocurre durante la reacción química y al mismo tiempo constatar que todas las ecuaciones químicas se ajustan a lo que establece la Ley de conservación de la materia: la suma de las masas de los reactivos es igual a la suma de la masa de los productos, es decir, “La materia no se crea ni se destruye, solo se transforma”.
Para balancear una ecuación se deben buscar los coeficientes adecuados para las fórmulas químicas en la ecuación original. En una ecuación química, el coeficiente es el número escrito previo al reactivo o producto. Los coeficientes son generalmente números enteros y no se escriben si el valor es 1.
Observa el siguiente ejemplo:

Un coeficiente indica el menor número de partículas de la sustancia involucrada en la reacción.
Para realizar el balance por inspección de una ecuación química debes de llevar a cabo los siguientes pasos:
Escribe la ecuación con la estructura básica para la reacción. Debes considerar la escritura adecuada de las fórmulas y símbolos de todas las sustancias participantes.

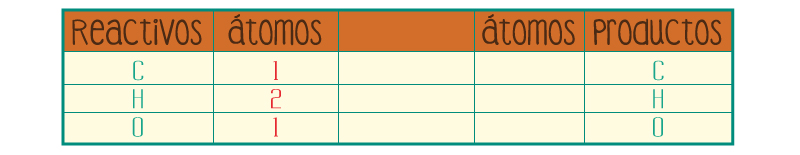
Cuenta los átomos de los elementos de los reactivos.

Participan:
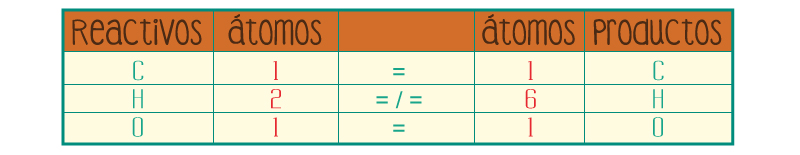
Cuenta los átomos de los elementos de los productos.

Participan:
Coloca los coeficientes necesarios para que el número de átomos de cada elemento sea igual en ambos lados de la ecuación. Los coeficientes deben ser números enteros lo más pequeños posibles. NUNCA cambies los subíndices de una fórmula química para balancear la ecuación porque cambiarás la identidad química de la sustancia.
Como puedes observar, tanto en los reactivos como en los productos hay el mismo número de átomos de carbono y de oxígeno, en cambio el número de hidrógenos es diferente.

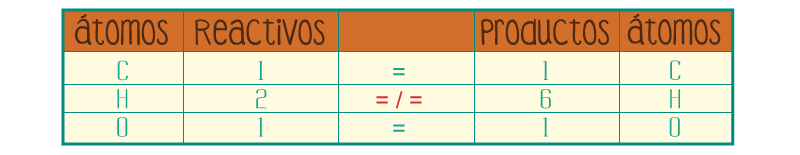
Para poder igualar el número de hidrógenos tanto en los reactivos como en los productos, se agrega un coeficiente 3 al hidrógeno de los reactivos:

Así entonces, de tener 2 hidrógenos, la fórmula de los reactivos consigue tener 6, tal como en los productos de la fórmula.

Como podrás observar, al colocar un coeficiente de 3 en el H2 la ecuación queda balanceada.



