Electronegatividad: atracción por los electrones
Puedes imaginar el enlace entre los átomos como una “lucha de tira y afloja” por los electrones de valencia. Para usar este modelo de reparto de electrones necesitas tener una forma de determinar la atracción que ejerce cada átomo sobre los electrones compartidos, la medida de esa fuerza es la electronegatividad.
La electronegatividad de un elemento es definida como la capacidad relativa de un átomo para atraer electrones de otro átomo para enlazarse químicamente y formar un compuesto.
La electronegatividad es una propiedad periódica. En la siguiente tabla observarás la variación de la electronegatividad, ésta va aumentando de izquierda a derecha a lo largo de los periodos, y de abajo a arriba dentro de cada grupo. Es necesario aclarar que los valores de electronegatividad fueron asignados con base en una escala arbitraria denominada escala Pauling. El elemento que presenta el valor más alto (mayor electronegatividad) es el Flúor (F) con 4 unidades Pauling, mientras que los valores más bajos (menor electronegatividad) corresponden al Cesio (Cs) y al Francio (Fr) con 0.7.
En los elementos de transición los valores de electronegatividad presentan ligeras variaciones, observa este sector de la tabla periódica para que aprecies los pequeños cambios en la regularidad.

Como la electronegatividad varía en forma periódica, puedes predecir la diferencia de electronegatividad que existe entre los átomos enlazados observando la distancia que los separa en la tabla. En general, mientras más separados se encuentren en la tabla periódica, mayor será la diferencia de electronegatividades entre los átomos. Observa los siguientes ejemplos en la tabla periódica:
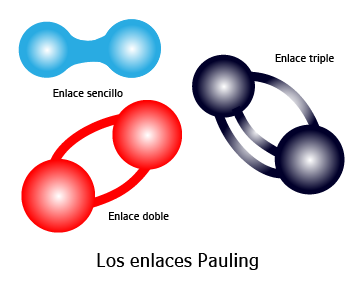
- La unión entre el cesio y el flúor cuya diferencia de electronegatividad es 4.0-0.7= 3.3 (fluoruro de cesio); este valor es la diferencia más grande que puede haber entre dos átomos diferentes y se considera un enlace iónico.
- La unión entre el carbono y el azufre cuya diferencia de electronegatividad es 3.5-2.5 =1 (sulfuro de carbono) que es un enlace covalente polar.
- La unión entre azufre y carbono 2.5-2.5=0 (disulfuro de carbono) que es un enlace covalente puro o no polar.
Esto se puede comparar con una tabla de diferencia de electronegatividad:
 Diferencia entre cero y 0.4 = enlace covalente no polar
Diferencia entre cero y 0.4 = enlace covalente no polar Diferencia mayor a 0.5 y menor a 1.6 = enlace covalente polar
Diferencia mayor a 0.5 y menor a 1.6 = enlace covalente polar Diferencia entre a 1.7 y 3.3 = iónico
Diferencia entre a 1.7 y 3.3 = iónico
Las características de los tipos de enlace se explican con mayor profundidad a lo largo de este material.
Para saber más
Sobre Linus Pauling: un partidario del conocimiento y la paz, da clic aquí.
Linus Pauling: un partidario del conocimiento y la paz
Algunos lo proclaman como uno de los 20 científicos más grandes de todos los tiempos; sin embargo, Linus C. Pauling considera que simplemente estaba bien preparado y que estuvo en el lugar correcto en el momento preciso. Eso ocurría a mediados de 1920, en los inicios de la física cuántica.
Teoría cuántica de la química. En 1926, Pauling obtuvo un doctorado en química en el Instituto de Tecnología de California, donde estudio la estructura cristalina de materiales.
Un año después, recibió la beca Guggenheim y viajó a Europa para estudiar la teoría cuántica del átomo. De regreso al Instituto de Tecnología de California, Pauling combinó sus conocimientos de la estructura de materiales y de la teoría cuántica en el concepto de enlace químico. Su libro La naturaleza del enlace químico tuvo una influencia determinante para los científicos en el estudio y predicción de estructuras, y en la investigación de las propiedades de compuestos inorgánicos, orgánicos y bioquímicos. Como reconocimiento a la importancia de su trabajo para la comprensión del enlace químico, Pauling recibió el Premio Nobel de Química en 1954.
Armamentos antinucleares
Pauling fue un abierto crítico de las pruebas de las bombas nucleares en la atmósfera. Estaba convencido de que la diseminación de radiactividad que provocaban estos ensayos tendrían efectos nocivos para la humanidad durante muchas generaciones. Exhortó a los científicos del mundo para que sancionara la prohibición internacional de los ensayos de armas nucleares. La noticia de que Pauling había sido galardonado con el Premio Nobel de la Paz de 1962, coincidió con el día del primer veto parcial mundial de las pruebas nucleares.
Vitamina C
A principios de los años 1970, Pauling se convirtió en un defensor de los beneficios de la Vitamina C para la salud. Su libro La vitamina C y el resfriado común se convirtió en un “best seller”. Aunque sus ideas son controvertidas, Pauling estaba convencido de que la ingestión de grandes dosis de Vitamina C ayudaría a eliminar pequeñas molestias y posiblemente curar el cáncer.
*Este texto fue retomado del libro Phillips, J. (2000). Química: conceptos y aplicaciones. México: McGraw-Hill Interamericana. pp. 307.


