Dalton y el primer modelo atómico

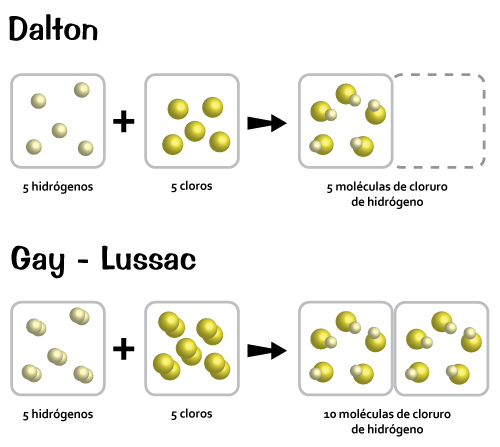
El inicio de la Teoría atómica fue de gran importancia para la ciencia, con ello se pretendía comprender el comportamiento de las sustancias durante los experimentos y así darles una explicación. Dalton es el iniciador de esta revolución científica. A continuación revisaremos su trabajo.
Datos biográficos
Químico y físico británico (1766 - 1844) que conjuntó las ideas que hasta el momento se tenían sobre la estructura de la materia.
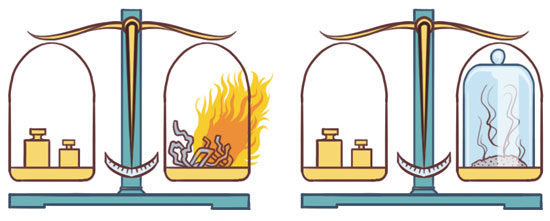
De los árabes tomó sus principios: creían que la transformación de un elemento en otro sería posible mediante un elíxir y producirían radiaciones (hay semejanza con el concepto de las reacciones nucleares) y los utilizó como operaciones unitarias (transferencias, cambio de energía y materiales en procesos físicos y físicoquímicos); de los persas retomó el concepto de volatilidad para los procesos de cambio de estado, de Lavoisier, el concepto de lo permanente para la conservación de la materia; de Leucipo la palabra “átomo” y lo asocia con el de “elemento” de Boyle; todo lo anterior le permitió elaborar una serie de hipótesis de trabajo que explicaban su posición ideológica sobre la estructura de la materia que llamó postulados, es el inicio de la Teoría atómica.
Te sugerimos que realices el Ejercicio 2.