Rutherford y el núcleo (ER)

Ernest Rutherford (1871-1937) físico y químico neozelandés, haciendo pasar un haz de partículas alfa a través de una laminilla muy delgada de oro logra deducir que la mayor parte del átomo es vacío y que existe una zona con carga positiva a la que llamó núcleo.
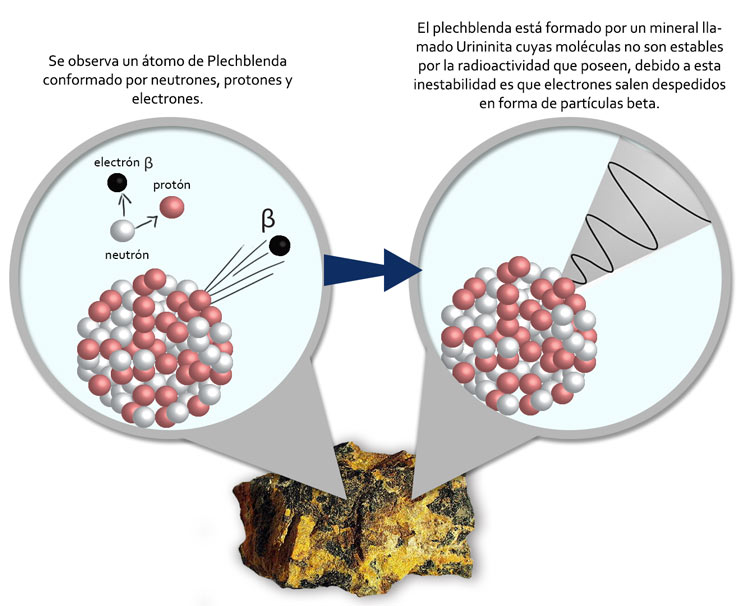
Retomó los trabajos de Bequerel que se interesó por las sustancias fluorescentes (fluorescencia) empleadas en los rayos catódicos y encontró que el plechblenda despedía cierta radiación descubriendo una nueva propiedad de la materia llamada radioctividad.
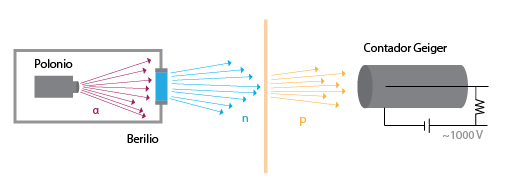
Rutherford, basó sus estudios en las partículas alfa, para estudiar su comportamiento colocó en una caja de plomo una muestra de radio y a cierta distancia una pantalla fluorescente y entre ambos una lámina de oro con un grosor de 4 x 10-5 m y observo lo siguiente:
La mayoría de las partículas alfa atraviesan la lámina de oro sin sufrir ninguna desviación, entonces debía haber espacios vacíos entre los átomos de oro.
Una de cada 40,000 partículas alfa se desvían en un ángulo mayor de 90° en la lámina de oro, esto implicaba la existencia de un núcleo con carga positiva que provoca esta desviación.
Una de cada 40,000 partículas alfa rebotaban en la lámina de oro, esto implicaba la existencia de un núcleo con carga positiva.
Con estas conclusiones propone su modelo atómico que consiste en:
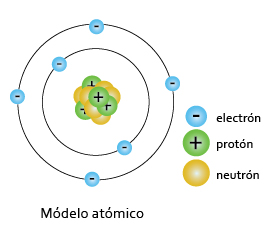
El centro del átomo está constituido por el núcleo donde reside su masa con carga positiva, a la que llamó protón, y una atmósfera electrónica compuesta de órbitas indeterminadas en las que se encuentran los electrones como el sistema planetario, por lo que debe haber espacio vacío; sin embargo, se tenían algunas dudas sobre este modelo y fue hasta 1920 que James Chadwick , con experimentos semejantes a los de Rutherford lo confirma y además descubre una partícula atómica con una masa igual a la del protón y sin carga a la que llamó neutrón . A continuación te mostramos una animación para que observes el experimento que realizó Rutherford.
Rutherford suponía que si el electrón está cargado eléctricamente y se encuentra en movimiento constantemente, utilizará energía, lo que provocaría que ésta disminuya gradualmente hasta agotarla y entonces el electrón caería hacia el nucleo destruyendo al átomo, sin embargo, su hipótesis no pudo ser demostrada.